Et si la vaccination pouvait se faire par simple application cutanée plutôt que par injection ? Une équipe de chercheuses et chercheurs de l’Institut national de la santé et la recherche médicale (Inserm), de l’Institut Curie et du King’s College London apporte de nouvelles connaissances sur le rôle des stimuli mécaniques dans les réponses immunitaires de la peau et ouvrent la voie à de nouvelles alternatives aux injections médicamenteuses.
La peau constitue la barrière protectrice de l’organisme contre les agressions de l’environnement : rayons UV, molécules toxiques… Elle doit constamment s’adapter pour assurer son rôle de façon efficace.
Elle est également soumise en permanence à des tensions mécaniques intrinsèques propres à sa structure complexe (1). Lors d’une blessure ou d’une inflammation cutanée ce « stress mécanique » joue un rôle immunitaire majeur, notamment en modulant finement l’action de certaines cellules immunitaires sensibles aux variations de tension dans la peau.
Concernant les contraintes mécaniques externes cependant, l’impact physiologique d’un stress mécanique causé par un étirement transitoire de la peau – comme lors de frottements ou de massages –, reste lui mal compris.
Une équipe de chercheuses et chercheurs coordonnée par Élodie Segura, directrice de recherche Inserm, au sein du laboratoire Immunité et cancer (Inserm/Institut Curie) et par Stuart. A. Jones, professeur et directeur du Centre for Pharmaceutical Medicine Research, au sein de l’Institute of Pharmaceutical Science (King’s College London) s’est intéressée à la façon dont le stress mécanique causé par un massage pouvait affecter l’immunité et l’imperméabilité protectrice de la peau.
Les scientifiques ont utilisé un outil permettant d’étirer la peau de façon à mimer, durant 20 minutes et sans induire de lésion, un massage appliquant sur la peau une tension similaire à celle d’un massage thérapeutique ou à l’application d’une crème. Ils ont ensuite comparé chez la souris et, pour une partie, chez des volontaires humains, plusieurs paramètres mécaniques, microbiologiques et physiologiques de la peau avec et sans massage.
Ils ont d’abord observé que le massage rendait la peau temporairement perméable aux très grosses molécules (ou macro-molécules) tant chez les humains que chez les animaux. Cette perméabilité apparaissait liée à une ouverture des follicules pileux (la cavité dans laquelle le poil prend sa naissance), qui, favorisée par le massage, permettait aux macro-molécules en surface de pénétrer dans le tissu cutané.
Chez les rongeurs, les chercheuses et chercheurs ont également observé que cette ouverture des follicules pileux autorisait l’entrée dans la peau de composés dérivés des bactéries présentes naturellement à sa surface (le microbiote cutané). Ce phénomène déclenchait alors une réponse immunitaire entraînant notamment une réaction inflammatoire locale et l’initiation de la réponse immunitaire dite « adaptative ». Cette immunité qui permet l’élimination hautement spécifique de pathogènes est à l’origine de la mémoire du système immunitaire et est stimulée par la vaccination.
« Ces résultats suggèrent que le stress mécanique agit comme un signal de danger au sein de la peau, indique Élodie Segura. L’entrée dans la peau de composés du microbiote favorisée par l’étirement pourrait ainsi alerter le système immunitaire local sur la perte d’imperméabilité de la barrière cutanée et l’activer pour répondre au potentiel danger. »
Forte de ces observations, l’équipe s’est intéressée à la possibilité d’exploiter ces propriétés pour développer une technique de vaccination non invasive par application cutanée. Elle a appliqué par massage un vaccin contre la grippe (H1N1) sur la peau de souris, et comparé la réaction immunitaire à celle produite en réaction à une injection intra-musculaire classique de ce vaccin.
« Des tests chez l’humain doivent être réalisés pour confirmer ces résultats observés chez la souris, car il existe des différences bien connues entre les peaux de nos deux espèces, précise Élodie Segura. Il nous faudra également comprendre comment chaque type de cellules cutanées réagit spécifiquement face au stress mécanique et quels sont précisément les produits du microbiote qui stimulent la réponse inflammatoire. Maîtriser ces processus chez l’humain pourrait ainsi permettre de développer des méthodes de vaccination ou d’administration de médicaments sans aiguille et non invasives », conclut la chercheuse.
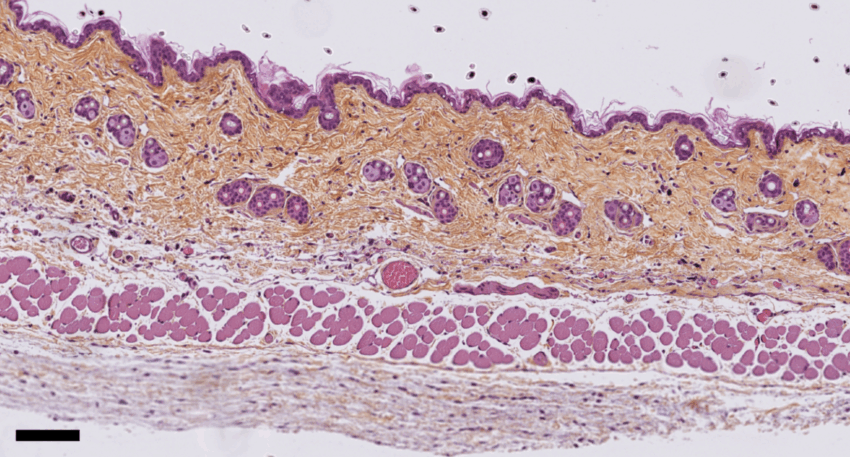
Mais ces résultats pourraient aussi avoir d’importantes implications d’un point de vue toxicologique. Ils suggèrent en effet que les frottements ou le massage de la peau pourraient favoriser la pénétration dans l’organisme de molécules nocives – polluants ou allergènes présents sur la peau ou dans des crèmes à application cutanées –, et stimuler des réponses immunitaires non désirées (inflammatoires ou allergiques). Or, à ce jour, les évaluations des risques chimiques d’un produit n’incluent pas la possibilité qu’une macro-molécule puisse entrer dans la peau. Des études complémentaires pourraient donc s’intéresser aux liens entre stress mécanique et sensibilisation aux allergènes. La peau présente une structure multicouches complexe, stratifiée en trois couches principales : l’épiderme (la plus externe), le derme et l’hypoderme (la plus interne). Chacune de ces trois couches est composée de cellules de types différents et présente une épaisseur variable selon les parties du corps mais aussi d’un individu à l’autre.
[1] La peau présente une structure multicouches complexe, stratifiée en trois couches principales : l’épiderme (la plus externe), le derme et l’hypoderme (la plus interne). Chacune de ces trois couches est composée de cellules de types différents et présente une épaisseur variable selon les parties du corps mais aussi d’un individu à l’autre.
Légende photo : Structure de la peau de souris après étirement, par coloration histologique. La barre d’échelle correspond à 100 micro-mètres. © Darawan Tabtim-On et Renaud Leclère – Plateforme de pathologie expérimentale de l’Institut Curie